Le but de ce travail a été d'augmenter le degré d'imprégnation du tissu tumoral et d'évaluer l'influence de la dose et de la vitesse d'administration sur la distribution d'un anticancéreux hydrosoluble, le méthotrexate, au sein des tumeurs cérébrales.La première étude a eu pour but d’établir s'il existait une relation proportionnelle entre la dose administrée par perfusion I.V. et les concentrations de l'anticancéreux dans le liquide extracellulaire de la tumeur. Après perfusion I.V. de deux doses de méthotrexate chez le Rat porteur d'un gliome C6, les profils d'évolution des concentrations de méthotrexate libre dans le tissu tumoral étaient établis par microdialyse et ceux des concentrations plasmatiques de méthotrexate par analyse du plasma. Un modèle prédictif des concentrations de la fraction libre du méthotrexate dans le L.E.C. de la tumeur a pu être établi.En raison du risque toxique auquel expose l'augmentation de la dose, la seconde étude avait pour objectif de déterminer l'influence de la vitesse d'administration sur l'évolution des concentrations de méthotrexate sous sa forme libre dans le liquide extracellulaire du tissu tumoral chez le rat porteur d'un gliome C6.II.1. Objectif
Les solutions de méthotrexate sont préparées à partir de flacons de 2 ml contenant 50 mg de méthotrexate (Lédertrexate; Wyeth-Lederlé, Paris, France). Le sérum physiologique utilisé est une solution stérile de NaCl à 0,09% du commerce (Fresenuis France Pharm, Sèvres, France). L’eau ultrapure est obtenue à partir d’un système Millipore-Q (Millipore, St Quentin en Yvelines, France). Les milieux de culture sont préparés à partir de Ham F12 (Life Technologies, Cergy Pontoise, France), de sérum de veau fśtal (Life Technologies, Cergy Pontoise, France), de streptomycine / pénicilline (Life Technologies, Cergy Pontoise, France), d'amphotéricine B (Institut Jacques Boy, Reims, France) et de glutamine (Institut Jacques Boy, Reims, France). Le formol tamponné de Lillie est constitué d'un mélange de formaldéhyde à 40 % (Prolabo, Fontenay-sous-bois, France) et d'un tampon phosphate (10/90 ; v/v) contenant du NaH2PO4 (29,0 mM) et du Na2HPO4 (36,5 mM) (Réactifs Merck, OSI, Maurepas, France).II.2. Protocole experimental
II.2.1. Solutions et réactifs
Des rats Wistar mâles de poids 280 ± 20 g (Elevage Dépré, St Doulchard, France) sont stabulés dans un environnement contrôlé (température : 21 ± 2°C; humidité relative : 65 ± 15%, cycle naturel d’alternance lumière/obscurité). Une alimentation standardisée (U.A.R.; Villemoisson sur Orge, France) et de l’eau du robinet sont fournies ad-libitum. Une période d'acclimatation de 5 jours est respectée avant le début de l’étude.II.2.2. Modèle animal
II.2.2.1. Réactif animal
Les cellules C6, initialement produites par injection hebdomadaire de N-méthylnitrosourée (6), sont cultivées sur plastique dans des boîtes de culture à 6 puits (Falcon, Poly Labo, Strasbourg, France) contenant un milieu minimum Ham F12 additionné de 10% de sérum de veau fśtal, 0,5 % de streptomycine, 0,5 % de pénicilline, 0,05 % d’amphotéricine B et 0,5 % de glutamine. Les boîtes contenant entre 200 000 et 300 000 cellules par puits sont placées dans un incubateur à +37° C sous atmosphère humide (95 %) et à 5 % de CO2. Après 3 à 4 jours, les cellules atteignent le stade de confluence et leur multiplication est arrêtée. Après élimination du milieu de culture, les cellules sont détachées du fond des boîtes au moyen d’une solution contenant de la trypsine à 0,05 % et de l'E.D.T.A. à 0,02 % (Life Technologies, Cergy Pontoise, France). Les boites sont maintenues à +37° C jusqu’à détachement complet des cellules. La réaction est alors stoppée par ajout de milieu Ham F12 additionné de 10 % de sérum de veau fśtal et les cellules sont mises en suspension dans du milieu minimum Ham F12. Après trois rinçages dans du milieu minimum Ham F12 contenant 10 % de sérum de veau fśtal, les cellules vivantes sont comptées sur cellule de Malassez (Poly Labo, Strasbourg, France) par la méthode au bleu trypan (Sigma-Aldrich, St Quentin Fallavier, France). Les cellules C6 sont ensuite mises en suspension dans du milieu Ham F12 à une concentration finale de 5.105 cellules par microlitre.II.2.2.2. Modèle de tumeur expérimentale : gliome C6
II.2.2.2.1. Culture des cellules de gliome C6
II.2.2.2.2. Mise en place des canules guides
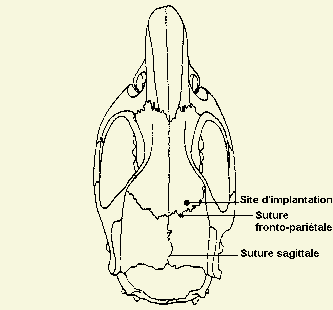
L'anesthésie est réalisée par injection intra-péritonéale d’une solution de xylazine 10 mg/kg (Rompun 2 % : Bayer Pharma, Sens, France) et de kétamine 100 mg/kg (Ketalar : Parke-Davis, Courbevoie, France). L'animal est placé dans un cadre stéréotaxique équipé d'un micromanipulateur (Modèle Stoelting 51600, Phymep, Paris, France). Une incision caudo-rostrale de la peau du crâne est pratiquée et l’os est mis à nu. Un trou (3 mm à droite de la suture sagittale et 1 mm en avant de la suture fronto-pariétale) est réalisé dans l’os à l’aide d’une fraise de dentiste (Anthogyr, Sallanches, France) (Figure 23). Quatre autres trous sont réalisés pour l'implantation de vis d'ancrage (Carnégie, Phymep, Paris, France) assurant le maintien du ciment acrylique (Autenal Dental, Harrow, Angleterre) sur la surface osseuse.

Une fois les vis d'ancrage mises en place, une canule guide (CMA/11 : Carnégie, Phymep, Paris, France) est implantée dans l’hémisphère droit, à l’aide du micromanipulateur (Figure 24). L’extrémité de la canule guide est amenée à une profondeur de 4 mm par rapport à la surface du cerveau et la canule guide est fixée au moyen de ciment acrylique.
 |
|
Figure 24. Canule guide |
A l'issue d'une période de 15 min nécessaire à la prise complète du ciment, 10 µl de la suspension de cellules C6 sont injectés à un débit de 5 µl/min à l’aide d’une micro-seringue équipée d’une aiguille de 11 mm de long dans l’hémisphère droit (Exmire 20 µl, Poly Labo, Strasbourg, France). Après avoir laissé l'aiguille en place dans la canule guide pendant 3 min après l’injection, afin d’éviter une remontée des cellules dans la canule guide, celle-ci est retirée et le mandrin de la canule guide est remis en place.II.2.2.2.3. Inoculation des suspensions de cellules C6
La perméabilité de la B.H.T. et de la B.H.E. était évaluée 14 jours après l’implantation de la tumeur par injection I.V. de 0,5 ml d'une solution de Bleu Evans (Sigma-Aldrich, St Quentin Fallavier, France) préparée à 2 % dans une solution de NaCl 0,09 %. Cinq rats sont anesthésiés à l’isoflurane (Laboratoire Bélamont, Neuilly sur Seine, France) et le bleu Evans est injecté en intrapudendale. Une heure plus tard, un cathéter est mis en place dans l’aorte thoracique, le cśur est perfusé avec 120 ml de sérum physiologique "glacé" (+4°C) et l’atrium droit est sectionné pour saigner l’animal. Après extraction du cerveau de la boite crânienne, l'examen des coupes macroscopiques permet d'apprécier la présence ou l'absence d’une coloration bleue, témoignant d'une modification de la perméabilité de la B.H.E. ou du maintien de son intégrité.II.2.3. Etude de la perméabilité de la barrière hémato-tumorale
Après une période de développement tumoral de 14 jours, les rats sont anesthésiés à l’isoflurane à l'aide d'un évaporateur (Isotec 4 : Ohmeda, Maurepas, France). L’induction de l’anesthésie est effectuée dans une cage en plexiglas dont l’atmosphère est saturée en anesthésique. Après mise en place d'une canule trachéale reliée à un respirateur (Harvard Apparatus, Les Ulis, France), l’anesthésie est entretenue avec 1 à 1, 5% d’isoflurane.La fréquence respiratoire est adaptée à chaque animal en fonction de son poids à l’aide d’une abaque. Le volume courant délivré à l’animal est contrôlé en continu par le suivi du CO2 téléexpiratoire à l’aide d’un analyseur de CO2 (Engström eliza, Paris, France). Le maintien des valeurs entre 4 et 4,7 % assure le respect des normes physiologiques. Les conditions d'anesthésie ont été adaptées par un contrôle de la pCO2, pO2 et le pH du sang artériel déterminés au moyen d’un analyseur de gaz du sang (Modèle 178 : Ciba Corning, Chiron Diagnostics, Paris, France). Pendant toute la durée de l’étude, la température des animaux est maintenue à l’aide d’un système contrôlé de maintien de la température corporelle (Homeothermic blanket system, Phymep, Paris, France).II.2.4. Anesthésie
L’animal anesthésié est placé en décubitus dorsal et un cathéter connecté à une seringue électrique à microdébit (CMA/100, Carnégie, Phymep, Paris, France) est inséré dans la veine jugulaire gauche pour permettre l'administration de la solution de méthotrexate.II.2.5. Modalités d’administration
La solution de méthotrexate est préparée extemporanément dans du soluté physiologique (NaCl 0,09 %). La concentration est adaptée au poids de chaque animal pour permettre l'administration à vitesse constante (16,7 µl/min) pendant 240 min d'une dose totale de 50 mg/kg de méthotrexate chez six animaux et de 100 mg/kg chez six autres.II.2.5.1. Perfusion intraveineuse
Une dose de méthotrexate de 50 mg/kg est administrée à partir d’une solution à une concentration de 10 mg/ml et injectée à un débit de 1 ml/min.II.2.5.2. Injection intraveineuse unique et rapide
Les prélèvements sanguins sont réalisés au moyen d'un cathéter rempli de sérum physiologique hépariné (héparine 25 000 UI/ml, Laboratoire Léo, France) mis en place dans l’artère carotide droite. Le sang (200 µl) est recueilli dans des tubes en polyéthylène héparinés (Treff Lab, Poly Labo, Strasbourg, France; héparine 25 000 UI/ml, 8 µl par tube; Laboratoire Léo, France), avant injection du méthotrexate, et aux temps : 37,5, 82,5, 127,5, 172,5, 232,5, 262,5, 277,5, 292,5, 322,5, et 352,5 min après le début de la perfusion, ou aux temps : 2,5, 7,5, 15, 22,5, 37,5, 67,5, 127,5, 172,5 et 232,5 min après la fin de l’injection I.V. unique et rapide. Afin de minimiser les risques d’hypovolémie, un volume équivalent de soluté physiologique (NaCl 0,09 %) hépariné est administré après chaque prélèvement. Le plasma est immédiatement séparé par centrifugation à 2 500 g à température ambiante (Microcentrifugeuse Sigma 112, Bioblock Scientific, France) pendant 15 min et conservé àII.2.6. Modalités de prélèvement
II.2.6.1. Sang
II.2.5.2. Dialysat
Une sonde de microdialyse CMA/11 (Figure 25), perfusée avec une solution de Krebs-Ringer (Sigma-Aldrich, St Quentin Fallavier, France) à un débit de 7 µl/min, est mise en place dans la canule guide. Les dialysats sont collectés par intervalles de temps de 15 min pendant 6 h pour les animaux perfusés et 4 h pour les animaux recevant une injection I.V. unique et rapide. Les dialysats sont congelés et conservés à -20°C jusqu’au moment de l'analyse (2 à 5 jours).
 |
|
Figure 25. Sonde de microdialyse CMA/11
|
En raison du faible volume de plasma disponible par échantillon (100 µl), la détermination des concentrations des formes libres n’a pu être réalisée pour chaque temps de prélèvement. Celle-ci a été déterminée par ultrafiltration d’un pool (» 200 µl) de plasma constitué par le mélange des échantillons recueillis après la fin de la phase de distribution. Le taux de fixation protéique est déterminé par calcul du rapport des concentrations mesurées dans le plasma et l'ultrafiltrat. L’adsorption éventuelle du méthotrexate sur les membranes d’ultrafiltration est évaluée au moyen de solutions à 0,5, 1 et 10 µg/ml préparées dans un tampon phosphate (pH 7,4) à partir d’une solution mère de méthotrexate à 2 mg/ml. La fixation du méthotrexate aux protéines plasmatiques est déterminée après ultrafiltration du plasma en utilisant un système Amicon MPS-1 et des membranes de type YMT (Amicon Division, France). Après centrifugation à 1000 g pendant 25 min à température ambiante, les ultrafiltrats sont conservés à -20°C jusqu’à analyse.II.2.7. Etude de la fixation protéique
Les rendements in vitro sont déterminés par immersion des sondes dans une solution de Krebs Ringer à la concentration de 50 µg/ml de méthotrexate et maintenue à +38° C. Une solution de Krebs Ringer est perfusée à un débit de 7 µl/min et une période de 30 min est respectée avant la réalisation du premier prélèvement. Le rendement est calculé en faisant la moyenne des rapports de concentration de méthotrexate mesurée dans chaque dialysat sur la concentration de méthotrexate présente dans la solution de Krebs Ringer dans laquelle la sonde est immergée. Huit prélèvements sont réalisés en continu par intervalles de 15 min, pour chaque sonde.II.2.8. Détermination des rendements de microdialyse
II.2.8.1. Rendement in vitro
II.2.8.2. Rendement in vivo
Le rendement in vivo est déterminé par dialyse inverse chez un groupe de cinq rats porteurs d’une tumeur cérébrale C6 préparés comme décrit précédemment. Après 14 jours de développement, les animaux sont anesthésiés à l'isoflurane (induction: 5%; entretien : 1 à 1.5%). Une sonde de microdialyse implantée dans la tumeur est perfusée à un débit de 7 µl/min avec une solution de Krebs Ringer contenant du méthotrexate aux concentrations de 50, 230 et 300 ng/ml. Après un délai de 30 min, les dialysats sont collectés par intervalles de 15 min pendant 2 h. Le rendement correspond à la moyenne des rapports des concentrations perdues sur la concentration initiale de la solution perfusée :Rendement in vivo = (Cin - Cout) / Cin) x 100Cin : Concentration de méthotrexate dans le liquide de perfusionCout : Concentration de méthotrexate dans le dialysat
Les échantillons plasmatiques (150 µl) sont déprotéinisés par ajout d’un volume égal d’acide trichloroacétique 0,8 M (Prolabo, Fontenay-sous-bois, France). Après agitation au vortex pendant 1 min puis centrifugation à 2 200 g (Centrifugeuse BR 3.11, Jouan, Saint-Herblain, France) pendant 10 min, les surnageants sont directement injectés dans le système chromatographique. Les concentrations de méthotrexate dans les dialysats sont déterminées, après décongélation et agitation au vortex pendant 30 sec, par injection directe des échantillons dans le système chromatographique.II.2.9. Dosage du méthotrexate
Il est constitué d’une pompe (Model 400 SDS; Applied Biosystem; Eurosep Instruments, Cergy Pontoise, France), d’un injecteur (7125; Rhéodyne; Eurosep Instruments, Cergy Pontoise, France) équipé d’une boucle de 5 µl (Rhéodyne; Interchim, Montluçon, France) pour l’analyse des prélèvements sanguins et d’une boucle de 20 µl (Rhéodyne; Interchim, Montluçon, France) pour l’analyse des dialysats, d’un détecteur spectrophotométrique U.V. (Model 785A; Applied Biosystem; Eurosep Instruments, Cergy Pontoise, France) et d’un intégrateur (SP4400; Spectra-Physics; Eurosep Instruments, Cergy Pontoise, France). La séparation est réalisée sur une colonne C18, équipée d’une précolonne C18.II.2.9.1. Système chromatographique
Les conditions chromatographiques correspondent à celles décrites par Devineni (55). La phase mobile est constituée d'un mélange de méthanol (SDS, Peypin, France) et d’un tampon phosphate (20/80 ; v/v) contenant du K2HPO4 40 mM (SDS, Peypin, France). Le pH est ajusté à 7,0 par addition d’acide orthophosphorique à 85% (SDS, Peypin, France). La phase mobile est préparée extemporanément, filtrée (Millipore 0,45 µm; Poly Labo, Strasbourg, France) et dégazée sous vide dans un bain à ultrasons (Branson 2210, Bransonic, OSI, Maurepas, France). Le débit est de 0,3 ml/min et la détection est effectuée à 307 nm.II.2.9.2. Conditions chromatographiques
Les courbes d’étalonnage sont obtenues par surcharge de plasma de rat aux concentrations de 0,125, 1,25, 12,5, 31,5, 62,5 et 300 µg/ml.II.2.9.3. Gammes d’étalonnage
II.2.9.3.1. Plasma
Les gammes d’étalonnage sont obtenues par surcharge de la solution de Krebs Ringer aux concentrations de 3,13, 6,25, 12,50, 31,50, 62,50 et 125,00 ng/ml.II.2.9.3.2. Dialysat
Des études histologiques sont systématiquement pratiquées chez tous les rats à la fin de chaque expérimentation en vue d'identifier le site d'implantation de la sonde dans le tissu tumoral.II.2.10. Histologique
Après chaque étude, une thoracotomie est réalisée et un cathéter est mis en place dans l’aorte thoracique. Une fixation in situ des tissu est réalisée par injection de 120 ml de formol tamponné de Lillie dans l’aorte en direction du cśur après section de l’atrium droit. Le cerveau est ensuite extrait de la boite crânienne et conservé à +4° C dans du formol tamponné de Lillie.II.2.10.1. Fixation et extraction des cerveaux
Des coupes macroscopiques de 2 à 3 mm au niveau de la zone d’implantation de la sonde sont réalisées et disposées en cassette pour être incluse dans de la paraffine. Après déshydratation par passage dans des bains successifs d’alcool (Prolabo, Fontenay-sous-bois, France) puis de xylène (Carlo Erba Réactifs, Val de Reuil, France), ces coupes sont incluses dans de la paraffine (Carlo Erba Réactifs, Val de Reuil, France). Des coupes microscopiques de 5 µm sont réalisées à partir des blocs de paraffine ainsi préparés (Microtome, Microm France, Francheville, France).II.2.10.2. Inclusion et coupes des cerveaux
Les coupes microscopiques sont colorées par la technique Hèmatoxyline Erythrosine Safran (H.E.S.). L’hèmatoxyline (Merck, Chelles, France) colore le noyau en violet, l'érythrosine (Merck, Chelles, France) colore le cytoplasme en rose et le safran (R.A.L., Descharmes, Heillecourt, France) colore les protéines du tissu conjonctif en jaune.II.2.10.3. Coloration des coupes
Un système simple d'appréciation (absence, modéré, ou sévère) permet d'évaluer l'absence ou le degré de l'śdème, de la nécrose et de l’inflammation. La densité vasculaire de la tumeur et de la zone immédiatement périphérique à la tumeur, exclusion faite des zones nécrotiques et hémorragiques, est estimée en calculant le nombre moyen de vaisseaux sanguins dans cinq champs (x400) pour chaque coupe.II.2.10.4. Observations microscopiques des coupes de cerveaux
Les paramètres pharmacocinétiques du méthotrexate (VC, k10, k12, k21, et fraction tissulaire libre fTu) sont déterminés pour chaque animal par régression non linéaire en prenant simultanément en compte les profils des concentrations de méthotrexate dans le plasma et dans le liquide extracellulaire de la tumeur grâce à l’utilisation du logiciel Ph/Edsim (Ph/Edsim Professional 2.05, Mediware B.V., Groningen, Hollande). Le choix du modèle décrivant l’évolution des profils de concentrations de méthotrexate est basé sur la comparaison des valeurs du critère d’Akaike.Les concentrations de méthotrexate déterminées dans le liquide extracellulaire sont corrigées par la valeur du rendement in vivo. Du fait de la faible valeur de l'intervalle de temps utilisé pour la collecte de chaque échantillon, la valeur médiane de chacun de ces intervalles est retenue comme temps de prélèvement pour chaque concentration mesurée.La demi-vie de distribution est déterminée à partir de la formule : t˝a = Ln2 / a , avec a , pente de la phase de distribution. La demi-vie d’élimination plasmatique est calculée à partir de la formule suivante : t˝b = Ln2 / b , avec b , pente de la phase terminale d'élimination. L’aire sous la courbe des concentrations plasmatiques (AUCPlasma total), est calculée par la méthode des trapèzes et correspond à l’aire sous la courbe du temps 0 à 240 min. La clairance totale (CLT) est calculée en divisant la dose par l’AUCPlasma total. Le volume de distribution à l'équilibre (Vdss) est déterminé par le rapport : CLT x MRT. Le degré d'exposition de la tumeur au méthotrexate est déterminé par le rapport des aires sous la courbe dans le liquide extracellulaire tumoral et dans le plasma (AUCLEC(0-240)/AUCPlasma total(0-240)).II.2.11. Calcul des paramètres pharmacocinétiques
II.2.12. Simulation pharmacocinétique
Les concentrations de méthotrexate libre dans le tissu tumoral (CTu) sont estimées à l’aide des paramètres obtenus par analyse des seules concentrations plasmatiques de méthotrexate totales, à partir de l’équation :
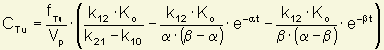
où fTu représente la fraction libre de méthotrexate dans le tissu tumoral. Les valeurs individuelles de fTu correspondent aux rapports des volumes de distribution périphériques théoriques (Vc x k12/k21) et expérimentaux (régression non linéaire) : Vpthéorique / Vpexpérimental. Les valeurs moyennes de fTu sont calculées à partir des valeurs individuelles par régression non linéaire simultanée des profils de concentration de méthotrexate dans le plasma (concentrations totales) et dans le liquide extracellulaire des tumeurs (concentrations libres).
La comparaison des résultats est effectuée par le test non paramétrique de Mann-Whitney au moyen du logiciel Statgraphics Plus (Version 1, Manugistics, Rockville, U.S.A.) avec un seuil de signification p < 0,05.II.2.13. Analyse statistique